Viscerální leishmanióza jako příčina horečky nejasného původu: jedinečný obraz nemoci na [18F]-FDG PET/CT
Gregor Horňák1, Peter Turcsányi2, Vojtěch Látal2, Kateřina Aiglová3, František Stejskal4, Tomáš Tichý5, Ivana Zicklerová6, Libuše Quinn1
+ Pracoviště
Souhrn
Následující kazuistické sdělení popisuje případ 69letého muže s viscerální leishmaniózou. Progresivně se horšící klinický stav nemocného spolu s chudým nálezem na zobrazovacích metodách a nespecifickými laboratorní nálezy vedly k diagnostickým úskalím tohoto v České republice raritně zachyceného infekčního onemocnění. Práce je doplněna o přehled recentních epidemiologických dat, diagnostických postupů a léčbu leishmaniózy.
Klíčová slova
leishmanióza, PET/CT, horečka nejasného původu, hepatopatie
Úvod
Hybridní zobrazování pomocí [18F]-FDG PET/CT je jednou z nejrozšířenějších, nejmodernějších a dynamicky se rozvíjejících metod užívaných zejména v onkologické diagnostice. Pozitronová emisní tomografie (PET) poskytuje funkční snímky, které zobrazují průměrnou distribuci radiofarmaka – „zobrazení metabolizmu“ v definovaném časovém okamžiku. Daná distribuce radiofarmaka je posuzována pomocí kvantitativního ukazatele, standardizované hodnoty utilizace (SUV – standardized uptake value) měřené v jeden časový okamžik. Sdružuje výhody rutinně užívaných metod – pozitronové emisní tomografie (PET) a výpočetní tomografie (CT) [1,2].
V současné době je 2-[18F]-fluoro-2-deoxy-D-glukóza nejrozšířenějším radiofarmakem pro PET/CT vyšetření, zejména pro její dobrou dostupnost a relativně dlouhý fyzikální poločas rozpadu 18F (T1/2 = 110 min). Další výhodou radiofarmaka je jeho dobře prozkoumaná farmakokinetika, která vychází z glykolýzy. Jelikož jde o strukturální analog 2-deoxy-D-glukózy, je stejně jako glukóza transportován do buňky glukozovými transportéry. Intracelulárně je radiofarmakum analogicky ke glukóze fosforylováno hexokinázou na FDG-6-fosfát, který kvůli přítomnosti navázaného radioizotopu nepokračuje dál v glykolytické dráze a hromadí se v buňce v závislosti na intenzitě jejího glukózového metabolizmu. Většina nádorových či zánětlivých buněk (neutrofily a aktivované makrofágy) má ve srovnání s normálními tkáněmi vysokou glykolytickou aktivitu. Skutečnost, že i zánětlivá ložiska jsou hypermetabolická, může být zároveň příčina falešné pozitivity u vyšetření prováděných z onkologické indikace. V těchto situacích bývá odlišení etiologie mnohdy obtížné a je nám nápomocná morfologická charakteristika akumulujících lézí z CT části vyšetření. Své uplatnění má [18F]-FDG PET/CT také v pátrání po zánětlivém fokusu v daných indikacích: horečky nejasného původu, spondylodiscitida, vaskulitida velkých tepen, infekty cévních protéz a infekční endokarditida [1,2].
Vzhledem k rostoucí dostupnosti a počtu indikací pro PET/CT vyšetření se stále častěji objevují nálezy, které jsou nespecifické nebo nedostatečně charakterizované, což vede k širší diferenciální diagnostice. Jednou z těchto vzácných, avšak možných diagnóz s nespecifickým PET/CT obrazem je i leishmanióza. Jedná se o onemocnění způsobené intracelulárními parazity rodu Leishmania, který zahrnuje více než 20 morfologicky nerozlišitelných druhů. Přenašečem leishmanií je krevsající hmyz dvou rodů – Phlebotomus (ve Starém světě) a Lutzomyia (v Novém světě). Lidské leishmaniózy jsou většinou zoonózy. Infekce leishmaniemi vždy začíná v kůži, kde může být lokalizována po celou dobu onemocnění (kožní leishmanióza), nebo přestupuje do sliznic (kožně-slizniční, mukokutánní leishmanióza), či po téměř zanedbatelné kožní fázi invaduje vnitřní orgány (viscerální leishmanióza).
Viscerální leishmanióza (VL), známá jako kala-azar (black fever, černá horečka), je smrtelná v 95 % neléčených případů. Nejvíce výskytů je hlášeno z Brazílie, východní Afriky a Indie. Leishmanie napadají monocyto-makrofágový systém a způsobují organomegalii a pancytopenii, přičemž typické příznaky zahrnují horečku, splenomegalii a úbytek hmotnosti. Bez léčby pacienti umírají do 2 let, často na sekundární infekce či těžkou anemii [3,4]. Příznaky onemocnění se mohou rozvinout až po několika letech, zejména u asymptomatických jedinců, u nichž dojde k sekundárnímu potlačení imunitního systému (HIV, imunosupresivní terapie, koinfekce apod.) [5].
Diagnostika VL závisí zejména na laboratorních metodách včetně sérologických nástrojů, na morfologickém průkazu intracelulárních parazitů v kostní dřeni nebo na detekci nukleových kyselin prvoků za pomoci polymerázové řetězové reakce (PCR – polymerase chain reaction) [6]. I přesto může být diagnostika velmi obtížná, zdlouhavá a může vést k řadě diagnostických rozpaků zejména kvůli omezeným zkušenostem s touto nozologickou jednotkou v České republice. Národní referenční centrum pro analýzu epidemiologických dat uvádí v součtu deset hlášených případů leishmaniózy v období roků 2015–2024.
Popis případu
Muž (69 let), dosud léčený pro diabetes mellitus 2. typu, arteriální hypertenzi a dyslipidemii, byl od prosince 2023 došetřován pro perzistentní horečky a suchý kašel. Dlouhodobě si stěžoval na únavu, malátnost, zpomalenost, nechutenství a dušnost. Při klinickém vyšetření byla přítomna hepatomegalie 3 cm pod pravým žeberním obloukem. Provedená laboratorní vyšetření odhalila zvýšené zánětlivé parametry: C-reaktivní protein 110 mg/l (norma do 10 mg/l), prokalcitonin 1,10 µg/l (norma do 0,50 µg/l), hladina laktátdehydrogenázy 14,43 µkat/l (norma do 4,1 µkat/l), aminotransferázy ALT 3,69 µkat/l (norma do 0,78 µkat/l), AST 3,04 µkat/l (norma do 0,67 µkat/l). Dále pro elevaci D-dimerů (21 000 µg/l [norma do 700 µg/l]) byla provedena CT angiografie plicnice, která vyloučila tromboembolickou příhodu. V krevním obraze dominovala středně těžká až těžká normocytární normochromnní anemie s hodnotami hemoglobinu mezi 80 a 90 g/l, lehká trombocytopenie 90 × 109/l a lymfopenie s absolutní počtem lymfocytů 0,55 × 109/l. Opakovaný kultivační ani sérologický screening neodhalil etiologické infekční agens. Nemocný byl empiricky léčen perorálními antibiotiky s pouze malým přechodným efektem.
Cestou gastroenterologie byla doplněna tranzientní elastografie jater s nálezem fibrózy stadia S0 F2–3 (obr. 1a), splenomegalie a dále byla zjištěna hraniční pozitivita protilátek anti-LKM (anti-liver kidney microsomal antibody) a anti-sp100, která byla ovšem při opakovaném vyšetření negativní. Doplněná gastroskopie odhalila chronickou gastrobulbitidu s prokázaným pozitivním testem na Helicobacter pylori, který byl řádně eradikován kombinací klaritromycinu, doxycyklinu a inhibitoru protonové pumpy, koloskopie byla s negativním nálezem.

V rámci dalšího komplexního došetřování se zaměřením na pátrání po neoplastickém procesu byla mimo jiné provedena elektroforéza sérových bílkovin s imunofixací a nálezem 11,96 g/l paraproteinu IgG kappa. V únoru 2024 bylo přistoupeno k prvnímu celotělovému [18F]-FDG PET/CT vyšetření. Toto vyšetření prokázalo zvýšenou difuzní akumulaci radiofarmaka v kostní dřeni, známou hepatomegalii, nicméně nemocný byl během vyšetření značně neklidný a nespolupracující, a proto nebylo možné spolehlivě hodnotit akumulaci radiofarmaka v oblasti epigastria.
Pro suspekci na monoklonální gamapatii pacient podstoupil vyšetření kostní dřeně včetně aspirace a trepanobiopsie s opětovně diagnosticky nepřínosným závěrem hyperplastické, pravděpodobně reaktivní hematopoezy bez průkazu detekce maligní populace. Vzhledem k diagnostickým rozpakům a setrvalým febrilním stavům, které vedly ke schvácenosti nemocného a celkovému zhoršování jeho stavu, bylo v květnu 2024 provedeno opětovné, tentokrát validní [18F]-FDG PET/CT vyšetření, které odhalilo difuzně zvýšenou akumulaci v lymfatických uzlinách při jaterním hilu do velikosti 22 × 10 mm (SUVmax 4,7) a v obou lalocích zvětšených jater (SUVmax 7,9), na CT byla popsána difuzně zhrubělá struktura parenchymu jater (obr. 2).

S přihlédnutím k horšícímu se stavu nemocného, k minerálovému rozvratu, opakovaným hospitalizacím s neúčelnou širokospektrální antibiotickou terapií a k progresi hepatopatie – dle elastografie stadium S0 F4 (obr. 1b) – byla v červnu 2024 indikována necílená biopsie jater. V histologickém vzorku byla popsána periportální steatóza s vícečetnými drobnými epiteloidními granulomy, překvapivým nálezem byly histiocyty s intracytoplazmatickými mikroorganizmy (obr. 3a, b). Diferenciálně diagnosticky bylo pomýšleno na leishmaniózu, histioplazmózu, salmonelózu, toxoplazmózu a Q-horečku. Sérologické, mikroskopické, PCR a sekvenační vyšetření v Národní referenční laboratoři pro diagnostiku tropických parazitárních nemocí potvrdilo leishmaniózu s původcem Leishmania infantum. Při opakovaných cílených dotazech nemocný přiznává v předchorobí cesty na balkánský poloostrov, kde pravděpodobně došlo k nákaze. Pacient byl předán k další terapii na Kliniku infekčních nemocí Fakultní nemocnice Bulovka, kde byla zahájena antiparazitární léčba miltefosinem, která byla zvolena s ohledem na přítomnou renální insuficienci. Na zavedené terapii byl nemocný afebrilní, s poklesem zánětlivých parametrů a úpravou renálních funkcí. V kontrolních nátěrech kostní dřeně byly ojediněle nalezeny leishmanie. Po 4 měsících léčby bylo provedeno kontrolní ultrasonografické vyšetření s nálezem parciální regrese strukturálních změn parenchymu jater.


Diskuze
Horečka nejasného původu (FUO – fever of unknown origin) je diferenciálně diagnostický problém, který vyžaduje integraci různých klinických a diagnostických postupů k dosažení přesné diagnózy [7–9]. Konvenční i hybridní zobrazovací metody nukleární medicíny hrají významnou roli v diagnostickém algoritmu FUO při pátrání po možném infekčním fokusu nebo nádorové infiltraci. Pacienti s FUO, kteří jsou indikováni k provedení [18F]-FDG PET/CT vyšetření, představují stále rostoucí skupinu vyšetření na PET/CT pracovištích. Jak je z naší kazuistiky patrné, spolupráce nemocného a technicky precizně provedené vyšetření je zásadní pro validní interpretaci získaných dat.
Dle dostupné literatury existuje jen několik případových studií o použití [18F]-FDG PET/CT pro hodnocení pacientů s VL, všechny dostupné případy popisují pouze fokální či difuzní akumulaci radiofarmaka ve zvětšené slezině nebo extrasplenicky (kostní dřeň, lymfatické uzliny). Retrospektivní italská studie z let 2008–2017 semikvantitativně analyzuje 23 případů VL, PET pozitivní nález byl zaznamenán pouze u imunokompetentních jedinců a většina pacientů měla popsanou akumulaci ve slezině (difuzní nebo fokální) [10].
Naše kazuistika je výjimečná popisem difuzní akumulace radiofarmaka ve zvětšených játrech – obrazem tzv. superscanu jater a lymfatických uzlin v hilu jater (obr. 2). O takovém PET obraze viscerální leishmaniózy se autorům nepovedlo najít v literatuře zmínku.
Superscan je v nukleární medicíně užívané označení pro typ rozložení radiofarmaka v těle při difuzním metastatickém postižení skeletu na celotělových kostních scintigramech. Podobný termín se používá i u [18F]-FDG PET/CT zobrazování a je popsán jako primární vychytání radiofarmaka v jednom orgánu či orgánovém systému s redukcí nebo úplnou absencí aktivity v těch orgánech, které jsou normálně spojeny s fyziologickou distribucí [18F]-FDG. Orgány vykazující normální fyziologický příjem jsou zejména ledviny a vývodný močový systém, mozek a srdce (obr. 4a) [9]. Hepatický superscan, v literatuře nazývaný i jako tzv. horká játra, je charakterizován intenzivní akumulací radiofarmaka v játrech s potlačením pozadí fyziologické aktivity (obr. 4b) [11,12].
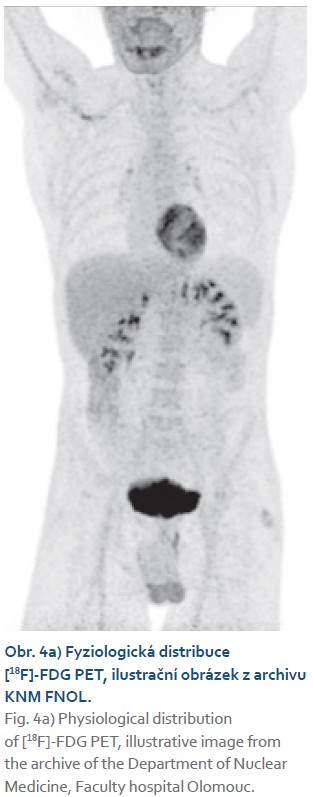
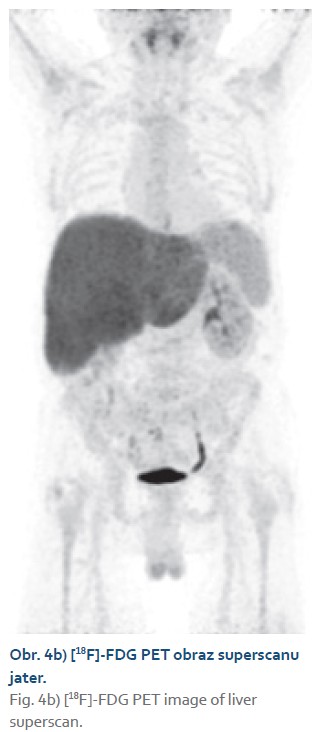
Difuzní intenzivní příjem [18F]-FDG v játrech je na PET zobrazování neobvyklým nálezem a je zpravidla spojen s malignitami, jako jsou masivní difuzní metastatické postižení jater (zejména při metastatickém postižení u karcinomu prsu), primární jaterní lymfom, difuzní angiosarkom jater, sekundární leukemické postižení jater a další. Infekční etiologie, jako je jaterní tuberkulóza nebo hepatitida způsobená různými infekčními agens, obvykle způsobí zvýšený příjem v játrech bez významného potlačení pozadí fyziologické aktivity [13–15]. Velmi vzácně se mohou i infekční nemoci manifestovat obrazem jaterního superscanu, což je situace v našem případě.
Závěr
Viscerální leishmanióza je velmi závažné infekční onemocnění, které představuje diagnostickou i terapeutickou výzvu. Precizní anamnéza včetně kompletní epidemiologické anamnézy je klíčová ke správnému nasměrování diagnosticko- -terapeutické rozvahy, zkracuje a usnadňuje cestu ke správné diagnóze a chrání pacienta před rizikem pozdních, život ohrožujících komplikací onemocnění.
Viscerální leishmanióza by měla být diferenciálně-diagnosticky zvažována při nálezu FDG-pozitivních ložisek sleziny a event. i jater u pacientů z endemických oblastí nebo s cestovatelskou anamnézou do zemí s vysokou incidencí leishmaniózy.
ORCID autorů
G. Horňák 0009-0003-2519-0963,
P. Turcsányi 0000-0003-0839-3841,
V. Látal 0000-0002-0775-4898,
K. Aiglová 0000-0002-8205-9051,
F. Stejskal 0000-0003-3440-513X,
T. Tichý 0000-0003-0755-1107,
L. Quinn 0000-0003-3686-3863.
Doručeno/Submitted: 26. 11. 2024
Přijato/Accepted: 2. 1. 2025
Korespondenční autor
MUDr. Gregor Horňák
Klinika nukleární medicíny
LF UP a FN Olomouc
Zdravotníků 248/7
779 00 Olomouc
gregor.hornak@fnol.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Votrubová J. Klinické PET a PET/CT. Praha: Galén 2009.
2. Kamínek M. Nukleární medicína. Olomouc: Univerzita Palackého v Olomouci 2024.
3. Burza S, Croft SL, Boelaert M. Leishmaniasis. Lancet 2018; 392(10151): 951–970. doi: 10.1016/S0140-6736(18)31204-2.
4. Handler MZ, Patel PA, Kapila R et al. Cutaneous and mucocutaneous leishmaniasis: clinical perspectives. J Am Acad Dermatol 2015; 73(6): 897–908. doi: 10.1016/j.jaad.2014.08.051.
5. McGwire BS, Satoskar AR. Leishmaniasis: clinical syndromes and treatment. QJM 2014; 107(1): 7–14. doi: 10.1093/qjmed/hct116.
6. van Griensven J, Dorlo TP, Diro E et al. The status of combination therapy for visceral leishmaniasis: an updated review. Lancet Infect Dis 2024; 24(1): e36–e46. doi: 10.1016/S1473-3099 (23) 00353-5.
7. Cunha BA, Lortholary O, Cunha CB. Fever of unknown origin: a clinical approach. Am J Med 2015; 128(10): 1138.e1–1138.e15. doi: 10.1016/ j.amjmed.2015.06.001.
8. Krivanová A, Adam Z, Mayer J et al. Fever of unknown origin – etiology and diagnostic algorithm. Vnitr Lek 2007; 53(2): 169–178.
9. Minamimoto R. Optimal use of the FDG-PET/CT in the diagnostic process of fever of unknown origin (FUO): a comprehensive review. Jpn J Radiol 2022; 40(11): 1121–1137. doi: 10.1007/s11604-022-01306-w.
10. Zanoni L, Varani S, Attard L et al. 18F-FDG PET/CT in visceral leishmaniasis: uptake patterns in the context of a multiannual outbreak in Northern Italy. Ann Nucl Med 2019; 33(9): 716–723. doi: 10.1007/s12149-019-01381-6.
11. Boellaard R, Delgado-Bolton R, Oyen WJ et al. FDG PET/CT: EANM procedure guidelines for tumour imaging: version 2.0. Eur J Nucl Med Mol Imaging 2015; 42(2): 328–354. doi: 10.1007/s00259-014-2961-x.
12. Jeong YJ, Sohn MH, Lim ST et al. „Hot liver“ on 18F-FDG PET/CT imaging in a patient with hepatosplenic tuberculosis. Eur J Nucl Med Mol Imaging 2010; 37(8): 1618–1619. doi: 10.1007/s00259-010-1477-2.
13. Wong SS, Yuen HY, Ahuja AT. Hepatic tuberculosis: a rare cause of fluorodeoxyglucose hepatic superscan with background suppression on positron emission tomography. Singapore Med J 2014; 55(7): e101–e103. doi: 10.11622/smedj.2013237.
14. Vijayakumary B, Ramachandran C, Bharath VM et al. Hot liver on 18F-FDG PET/CT imaging-a quandary for oncoradiologists in South Asia. BJR Case Rep 2020; 6(2): 20190097. doi: 10.1259/bjrcr.20190097.
15. Luk WH, Au-Yeung AW, Loke TK. Imaging patterns of liver uptakes on PET scan: pearls and pitfalls. Nucl Med Rev Cent East Eur 2013; 16(2): 75–81. doi: 10.5603/NMR.2013.0039.