Mirikizumab u nemocných s ulcerózní kolitidou – případy z klinické praxe
Milan Lukáš1, Dominik Bettenworth2, Viktorie Zacharová1
+ Pracoviště
Úvod
Terapie ulcerózní kolitidy (UC) doznává v posledních 10 letech přímo turbulentních a revolučních změn. Podíváme-li se na vývoj biologické a inovativní terapie u UC chronologicky, zjistíme, že až za 8 let po uvedení první biologické léčby pro Crohnovu nemoc (CN) v roce 1998 došlo k implementaci infliximabu (2006) do léčebných schémat u UC. Za dalších šest let (2012) se objevil vedolizumab a druhý anti-TNF preparát adalimumab. Od roku 2018 můžeme sledovat velkou akceleraci v zavádění nových léčiv; v tomto roce přišla první „malá molekula“ tofacitinib, jehož význam ještě nedovedeme úplně dobře docenit, došlo k rozšíření indikace u ustekinumabu pro UC, jenž byl od roku 2016 využíván k terapii CN. Tento skvělý výčet je po roce 2020 rozšířen o další nová léčiva především ze skupiny „malých molekul“, jako jsou ozanimod, filgotinib, upadacitinib a etrazimod.
V květnu 2023 povolila EMA (European Medical Agency) humanizovanou IgG4 monoklonální protilátku mirikizumab do léčby pacientů s UC. Jde o první anti-IL-23 protilátku, která selektivní inhibicí podjednotky p19 vyřazuje biologické účinky imunoregulačního cytokinu interleukinu-23 (IL-23), jenž byla zařazena do terapeutického armamentária UC. Protizánětlivý účinek spočívá v potlačení proliferace subpopulace Th17 lymfocytů s následným snížením tvorby interleukinů IL-22, IL-21 a IL-17.
Povolení k praktickému využití mirikizumabu vychází z pozitivních výsledků registrační studie fáze 3 LUCENT, v níž se potvrdila statisticky významně vyšší účinnost mirikizumabu v indukční (LUCENT-1) i v udržovací (LUCENT-2) terapii v porovnání s placebem. Vedle protizánětlivé účinnosti demonstrovala studie LUCENT také vynikající bezpečnostní profil tohoto léčiva, konečně jak je tomu u všech léčiv této skupiny. Na rozdíl od ostatních monoklonálních protilátek je mirikizumab IgG4 protilátka, která má dvě výhody proti IgG1 monoklonálním protilátkám: výrazně nižší potenciál indukovat tvorbu antiidiotypových protilátek proti léčivu a významně nižší schopnost prostupovat placentární bariéru. Běžné podávání mirikizumabu v českých podmínkách je určeno úhradovou vyhláškou, která jej určuje do druhé linie léčby po selhání alespoň jednoho léčivého přípravku biologické/cílené léčby. Indukční dávka léčiva se podává zpravidla po dobu 12 týdnů v dávce 300 mg i.v. 1× měsíčně a po dosažení terapeutického efektu se přechází na udržovací podávání mirikizumabu 200 mg s.c. 1× měsíčně. Jestliže není dosažen klinický efekt po třech indukčních infuzích, je možné, dovolí-li to stav pacienta, prodloužit indukční fázi o dalších 12 týdnů [1].
Od srpna 2024 máme možnost využívat tento nový lék také v České republice. Ve Spolkové republice Německo, kde platí jiné principy pro využití nových léčiv v klinické praxi, je mirikizumab od léta 2023 plně využíván u pacientů s UC. Zkušenosti našich německých kolegů jsou proto delší a také rozsáhlejší, než jsou naše. Uvítal jsem možnost spojit dvě kazuistiky našich českých pacientů se dvěma německými případy a napsat k nim malé komentáře. Profesor Dominik Bettenworth je německý odborník na IBD, který působí na univerzitě v Münsteru a má s touto terapií již velké zkušenosti. První dvě kazuistiky jsou z Münsteru a zbývající dvě z Klinického centra ISCARE.
Kazuistika 1
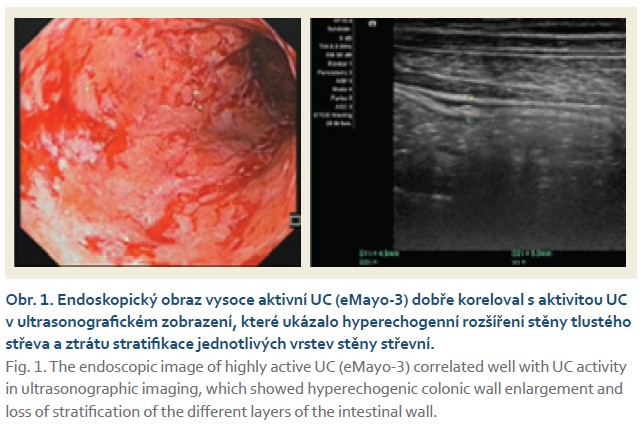
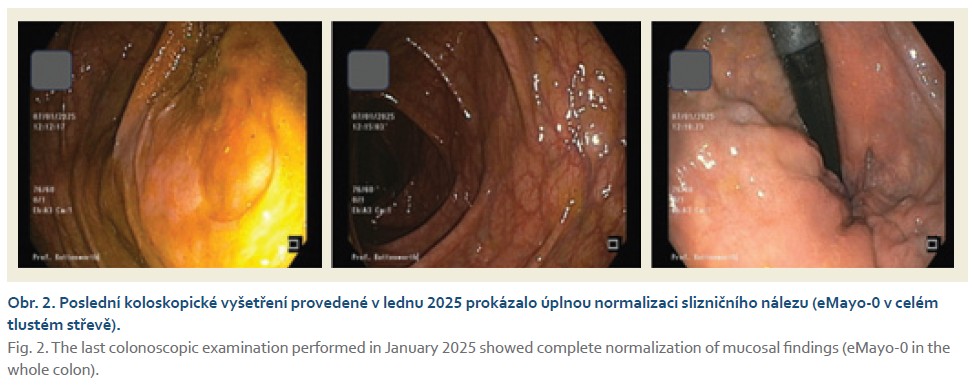
Muž narozený v roce 1982, nikdy vážně nestonal, pracuje jako zahradník. V roce 2019 mu byla diagnostikována UC a v době diagnózy se jednalo o pankolitidu s těžkým endoskopickým nálezem (eMao-3) prakticky v celém střevě, nebyly přítomny žádné mimostřevní projevy. Od května 2019 byla zavedena terapie mesalazinem lokálně a celkově v maximální terapeutické dávce, nicméně léčba nevedla během několika týdnů ke zlepšení stavu, a proto byla zavedena terapie systémovými kortikosteroidy. Klinický efekt byl velmi příznivý a rychlý, avšak při snížení kortikoidů na dávku 8 mg metylprednisolonu denně docházelo k aktivizaci zánětu. Pro zjevnou kortikodependenci byla v únoru 2020 zahájena biologická léčba infliximabem ve standardním režimu, bohužel nedošlo k žádné významné klinické ani laboratorní odpovědi. Pro primární neúčinnost byla léčba infliximabem po indukci ukončena. Pacient byl v květnu 2020 převeden na terapii vedolizumabem, který měl dobrý protizánětlivý efekt s dosažením klinické remise; na této terapii byl nemocný až do srpna 2022, kdy došlo k sekundární ztrátě odpovědi a k novému vzplanutí nemoci. Vzhledem k negativní zkušenosti s infliximabem a sekundární ztrátě odpovědi na vedolizumab byl pacient převeden na malou molekulu, na selektivní JAK-1 inhibitor upadacitinib. Terapie probíhala od září 2022 až do prosince 2023, kdy došlo na udržovací dávce upadacitinibu 30 mg denně k nové exacerbaci nemoci. Aktivita UC byla potvrzena laboratorně, endoskopicky a ultrasonograficky a také byla vyloučena nasedající infekce Clostridiodes difficile a cytomegalovirem (obr. 1). V lednu 2024 byla zavedena terapie mirikizumabem v indukční léčbě 300 mg i.v. 1× měsíčně; v týdnu 12 však nebyla dosažena větší klinická, endoskopická nebo laboratorní odpověď. Vzhledem k nepříznivému stavu pacienta bylo zvažováno provedení restorativní proktokolektomie s ileopouchanální anastomózou. Pacient však s chirurgickým řešením zásadně nesouhlasil. V této situaci byla jediná šance prodloužit indukční fázi léčby o dalších 12 týdnů a podat dalších tři infuze mirikizumabu v dávce 300 mg i.v. V červenci 2024 došlo po dokončení prodloužené indukční fáze ke klinickému zlepšení stavu, k významnému snížení hodnot fekálního kalprotektinu. Léčba pokračovala udržovací terapií mirikizumabem 200 mg s.c. 1× měsíčně. V říjnu 2024 bylo dosaženo kompletní a hluboké remise nemoci (obr. 2).
Komentář
První případ z münsterské kliniky nám představuje těžkého pacienta s extenzivním postižením tlustého střeva, který selhal na terapii dvou monoklonálních protilátek (infliximab, vedolizumab) a také JAK-1 inhibitorem (upadacitinib). Prodloužená indukční fáze mirikizumabem na celkovou dobu 24 týdnů byla u něho účinná a vedla nejen k významnému zlepšení stavu, ale později až ke kompletní remisi choroby. Popis případu dobře odráží zkušenosti ze zmíněné registrační studie LUCENT, která umožňovala nemocným bez odpovědi na standardní indukci v týdnu 12 pokračovat ještě další 3 měsíce (prodloužená indukce) v dávce 300 mg i.v. 1× měsíčně. V této studii se ukázalo, že 53,7 % nemocných, kteří neodpověděli v týdnu 12, vykazovalo významné klinické zlepšení v týdnu 24 a 11,4 % pacientů dosáhlo klinické remise. Většina nemocných, kteří do prodloužené indukce vstoupili, měla za sebou předchozí selhání na biologické léčbě. Důležité je zmínit, že nemocní s prodlouženou indukcí a pozitivní odpovědí v týdnu 24 měli v 75 % setrvalou klinickou odpověď v týdnu 52 a z nich polovina měla symptomatickou remisi choroby. Výsledky klinického výzkumu i popsaná klinická zkušenost dávají dobrou zprávu do klinické praxe, že nemocní, kteří nereagují na standardní indukci mirikizumbem, mohou profitovat po prodloužení indukce o dalších 12 týdnů. Samozřejmě v klinické praxi je vždy nutné rozhodnout individuálně u každého nemocného podle průběhu nemoci, výsledků předchozí terapie a také podle aktuálního celkového stavu pacienta, zda je prodloužení indukční fáze léčby relevantním krokem, nebo nikoli. Představa, že předcházející terapie anti-TNF vedla k selektování refrakterního klonu imunokompetentních buněk, které na svém buněčném povrchu exprimují receptor IL-23, se u popsaného pacienta pravděpodobně neuplatnila, protože nebyla zaznamenána jakákoli efektivita infliximabu, a to od počátku terapie. Spíše průběh nemoci podporuje představu, že patogeneze zánětu u UC je v porovnání s CN mnohem komplexnější s různými řídicími působky a odlišnými patofyziologickými cestami.
Kazuistika 2
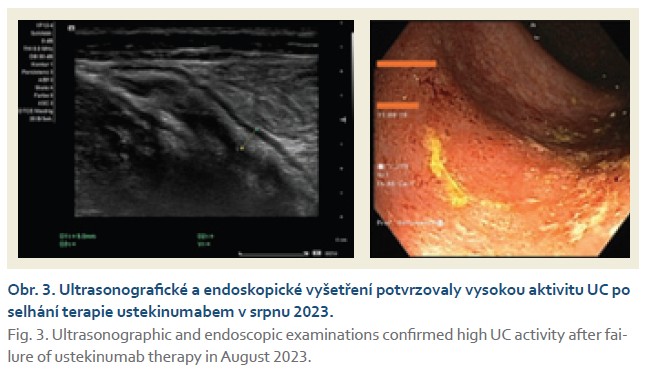
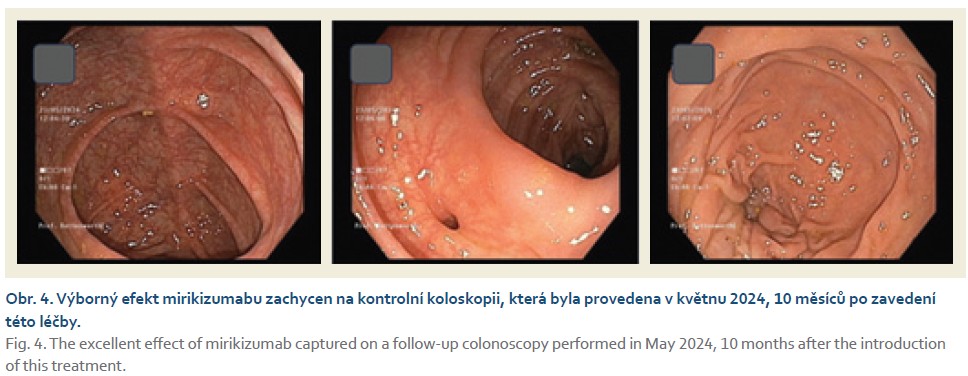
Žena narozená v roce 1990, pracuje jako architektka a trpí UC od roku 2014 s rozsahem postižení na levém tračníku. Od stanovení diagnózy byla zavedena konvenční terapie, která však byla spojena s intolerancí nebo vedlejšími efekty: při terapii mesalazinem měla vzácné projevy intolerance, terapie kortikosteroidy byla sice efektivní, ale brzy došlo ke vzniku kortikodependence, a po podání azathioprinu vyvinula pacientka akutní pankreatitidu. V červnu 2014 byla zahájena biologická terapie infliximabem nejprve ve standardním režimu. Po 1 roce léčby došlo ke ztrátě odpovědi a k sekundárnímu selhání, které nepomohla vyřešit ani dvojitá intenzifikace terapie infliximabem nebo pozdější převedení na adalimumab. Jednalo se o imunogenní selhání léčby s přítomností neutralizačních protilátek proti infliximabu a později také proti adalimumabu. V listopadu 2017 byla zahájena léčba vedolizumabem, na němž byla pacientka úspěšně léčena další 2 roky, avšak pak rovněž došlo ke ztrátě terapeutického efektu. V dubnu 2019 byla nemocná převedena na terapii ustekinumabem, na kterém profitovala až do srpna 2023, kdy se opět objevily silné projevy UC (obr. 3). V této situaci byla nemocné nabídnuta terapie JAK inhibitory. Jedná se o ženu, která plánuje v budoucnosti graviditu, a bezpečnost JAK inhibitorů v graviditě nebyla zatím jednoznačně potvrzena, proto nebyla tato léčba pacientkou akceptována. Jediným řešením byla terapie nejnovější monoklonální protilátkou zavedenou do klinické praxe. Léčba mirikizumabem proběhla ve standardním indukčním režimu na 12 týdnů a poté v udržovacím 200 mg s.c. 1× měsíčně. V listopadu 2023 byla ošetřujícím lékařem konstatována velmi dobrá klinická odpověď a v lednu 2024 byla potvrzena klinická a biochemická remise nemoci (obr. 4). V květnu 2024 byla provedena koloskopie s normálním nálezem v celém tlustém střevě.
Komentář
S podobnými pacienty, kteří mají intoleranci nebo závažné vedlejší efekty po mesalazinu, se gastroenterolog nesetkává často. Nicméně existují nemocní s UC, kteří jsou intolerantní na běžné a dobře snášené preparáty, jako jsou aminosalicyláty (mesalazin), a u některých z nich může dojít při celkovém nebo lokálním podání ke zhoršení UC, k indukci akutní pankreatitidy, nebo ke vzniku alopecie, nebo k některým kožním změnám jako erytema multiforme Hebrae. Na rozdíl od těchto vzácných vedlejších efektů mesalazinu jsou vznik kortikodependence a vedlejší efekty terapie azathioprinem „denním chlebem“ pro gastroenterology, kteří se problematikou IBD zaobírají. Druhým aspektem v této kazuistice je vícečetné selhání na monoklonální protilátky, které alespoň u anti-TNF léčiv bývá u 25 % pacientů podmíněno imunogenně, zprostředkované vznikem neutralizačních protilátek. Kolísající hladina anti-TNF podávaných intravenózně a IgG1 struktura imunoglobulinů (infliximab, adalimumab, golimumab) k tomu predisponují. Výhodou mirikizumabu může být u těchto pacientů velmi nízký imunogenní potenciál struktury IgG4 v porovnání s IgG1 monoklonálními protilátkami. Navíc je dobře známo, že tvorba neutralizačních protilátek je u nemocných, kteří je vytvořili v první linii léčby, v dalších liniích léčby spojena s vyšším rizikem jejich vzniku a jejich přítomnost vede k opakovanému selhání léčby. Až dlouhodobá klinická zkušenost s mirikizumabem ukáže, zda IgG4 monoklonální protilátky budou zárukou delšího efektu u nemocných, kteří měli imunogenně podmíněné selhání během předcházející biologické léčby.
Kazuistika 3
Žena narozená v roce 1978, s významnou rodinnou anamnézou: sestra trpí UC, pacientčiny dvě děti mají UC a CN, matka pacientky je léčena pro těžkou formu psoriázy. Diagnóza UC byla provedena v roce 2012 s extenzivním postižením tlustého střeva, v době diagnózy se středně vysokou zánětlivou aktivitou a s enteropatickou artritidou 1. typu. Nemocná byla léčena mesalazinem, topickým kortikosteroidy a přechodně také metotrexátem, protože azathioprin netolerovala. V roce 2018 byla zahájena léčba infliximabem, která měla sice pozitivní vliv na snížení intenzity střevních obtíží, avšak v průběhu léčby se objevila neuroborreliová infekce s těžším průběhem a terapie infliximabem musela být z tohoto důvodu ukončena. Od dubna 2019 do března 2021 dostávala ustekinumab, který byl účinný, ale po 2 letech byla terapie pro sekundární ztrátu odpovědi ukončena. V březnu 2021 vzhledem k trvajícím kloubním obtížím byla převedena na adalimumab, jehož dávka byla postupně intenzifikována, ale stejně v lednu 2024 byla terapie ukončena pro progredující aktivitu UC. V lednu 2024 jsme nasadili vedolizumab, ale po indukční fázi došlo k významnému zhoršení stavu a terapie byla ukončena. Od března 2024 byla zavedena terapie upadacitinibem, který rovněž nebyl účinný, nemocná musela být opět hospitalizována (obr. 5). V červenci 2024 byla podána první dávka mirikizumabu 300 mg i.v. a následovala standardní indukční terapie na 12 týdnů, po níž došlo k navození klinické remise UC (obr. 6). V listopadu 2024 byla potvrzena endoskopická remise a zhojení sliznice tlustého střeva (eMayo-1). V současné době dostává pacientka udržovací dávku mirikizumabem 200 mg s.c. à 4 týdny.
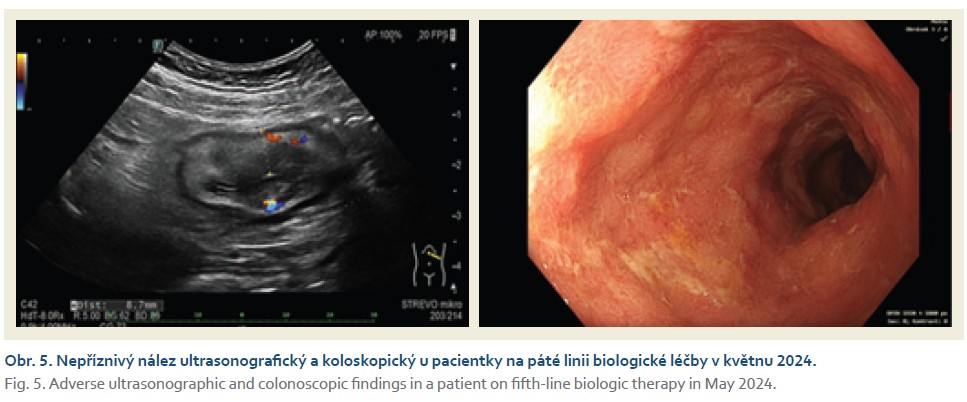
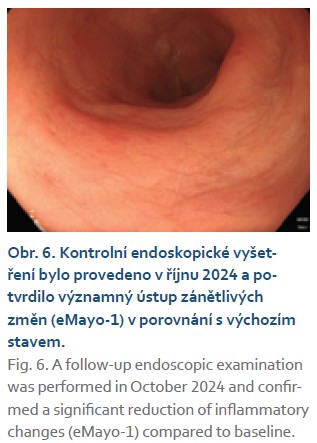
Komentář
Popsaná kazuistika je šťastným příkladem z klinické praxe ukazující na to že, mirikizumab může být velmi účinný i ve vysoké linii biologické a inovativní léčby, v tomto případě se jednalo již o šestou řadu biologických léčiv. V této situaci se spíše uvažuje o chirurgickém výkonu a provádí se předběžné konzultace s dedikovaným koloproktochirurgem. Pacientka měla těžký průběh UC a v letech 2023 a 2024 byla opakovaně hospitalizována a vždy byla vyloučena nasedající infekce. Jak vysvětlit tento šťastný příběh? Můžeme pouze spekulovat o tom, že u této pacientky je teorie selekce imunokompetentních buněk exprimujících receptor IL-23 po dlouhodobé terapii anti-TNF léky relevantním vysvětlením. Pacientka měla dobrou odpověď na úvodní léčbu infliximabem, léčba musela být ukončena pro koincidující neuroborreliovou infekci, nicméně efekt na střevní zánět byl vysoce pozitivní. Pak následovala různá léčiva, ale dlouhodobě efektivní bylo pouze podávání adalimumabu. Před několika lety popsala H. Schmidt z Erlangen v pokusech in vitro, že u pacientů, u nichž selhala terapie anti-TNF, je ve sliznici nadměrné množství CD14+ makrofágů, které zvýšeně exprimují receptor IL-23. I když to bylo potvrzeno u nemocných s CN, je dobře pravděpodobné, že podobně může být ztráta odpovědi na anti-TNF léčiva zprostředkována také u pacientů s UC. Podání mirikizumabu mělo promptní nástup a bylo relativně rychle dosaženo klinické, biochemické a endoskopické remise. Tato kazuistika také dobře dokumentuje efektivitu mirikizumabu u nemocných, kteří selhali na předcházející léčbu ustekinumabem.
Kazuistika 4
Žena narozená v roce 1986, nikdy vážně nestonala, se třemi porody přirozenou cestou v anamnéze, měla v roce 2020 diagnostikovanou UC s postižení rekta a sigmatu, se střední zánětlivou aktivitou. Po přechodné, ale relativně krátkodobé stabilizaci stavu při konvenční terapii topickými kortikosteroidy, mesalazinem a později systémovými kortikosteroidy byla později referována k zahájení biologické léčby. V srpnu 2022 byla zavedena terapie infliximabem ve standardním dávkovacím režimu s výborným efektem. V průběhu roku 2023 se začaly objevovat obtíže především na konci intervalu před podáním další infuze infliximabu, proto následovala intenzifikace terapie a zkrácení délky podávání na 6 týdnů. Přesto v průběhu února 2024 došlo k úplné ztrátě terapeutické odpovědi na podávaný infliximab, přičemž sérové koncentrace léčiva byly v terapeutickém rozmezí (9,7 μm/ml) a nebyly přítomny neutralizační protilátky (obr. 7). V dubnu 2024 byla zahájena léčba mirikizumabem ve standardním indukčním režimu, po 12 týdnech léčby se stav nemocné po stránce klinické trochu zlepšil, nicméně endoskopický nález vykazoval stále středně intenzivní (eMayo-2) aktivitu nemoci. Proto byla provedena prodloužená indukce na dalších 12 týdnů, stav se postupně zlepšoval a v říjnu 2024 bylo dosaženo klinické, biochemické a endoskopické remise nemoci (obr. 8).
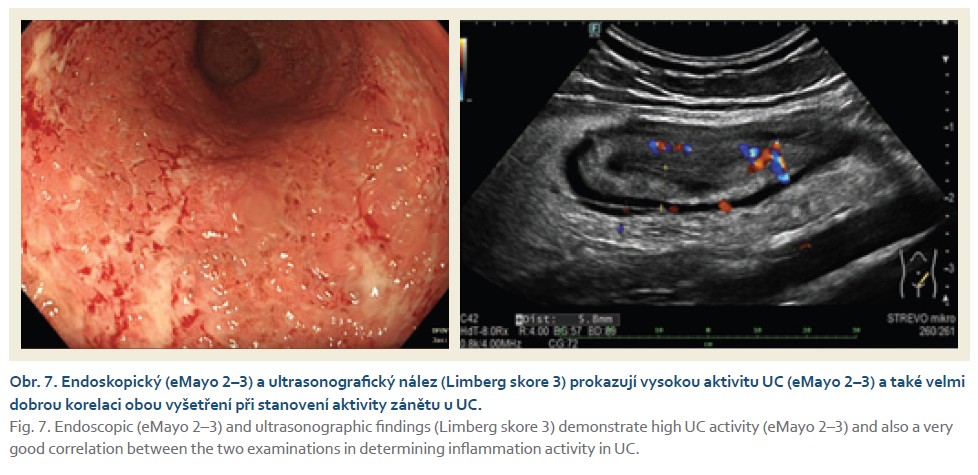
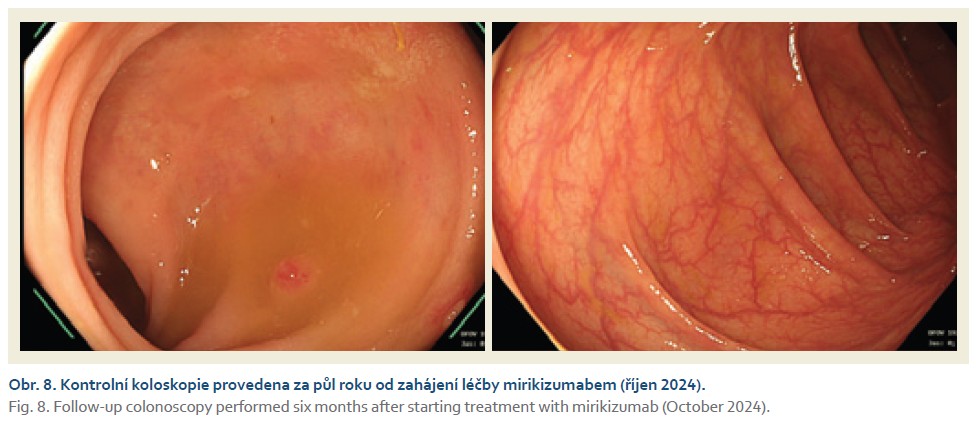
Komentář
Farmakokinetické monitorování léčby infliximabem umožnilo detekovat mechanizmus, který může vést ke ztrátě účinnosti biologické léčby. Dostatečná koncentrace infliximabu v séru podporuje tzv. ne-imunogenní – mechanistické selhání léčby, které si vysvětlujeme tím, že zánět je v daném okamžiku již řízen jinými mediátory a TNFalfa se již dominantně tak neuplatňuje. U pacientů s UC, kteří selžou na první anti-TNF léčbu infliximabem (mechanistické selhání), je několik možností, jak dále postupovat a co by měl klinik zvážit. Lék ze stejné skupiny, jako je infliximab, se stejným mechanizmem účinku nemá smysl podávat, vedolizumab sice působí zcela jiným protizánětlivým mechanizmem, než je tomu u anti-TNF, nicméně studie EVOLVE potvrdila, že u nemocných s UC po selhání infliximabu je efektivita vedolizumabu významně nižší než u pacientů, kteří jsou biologicky naivní. A tak jsou v prezentovaném klinickém scénáři dále dvě relevantní varianty léčby: JAK inhibitor nebo anti-IL23 působící anticytokiny (mirikizumab, nebo ustekinumab). Protože mirikizumab je selektivní protilátkou cílenou na podjednotku p19 IL-23 a má několikanásobně vyšší vazebnou aktivitu na p19 podjednotku IL-23 v porovnání s ustekinuamabem, který blokuje v patogenezi méně významný IL-12, preferovali jsme použít mirikizumab.
ORCID autorů
M. Lukáš 0000-0002-1463-3840,
D. Bettenworth 0000-0002-1435-4825.
Doručeno/Submitted: 15. 1. 2025
Přijato/Accepted: 7. 2. 2025
Korespondenční autor
prof. MUDr. Milan Lukáš, CSc., AGAF
Klinické a výzkumné centrum pro střevní záněty
Klinické centrum ISCARE a. s. a 1. LF UK v Praze
Českomoravská 19
190 00 Praha 9
milan.lukas@email.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Colwill M, Baillie S, Clough J et al. Role of Mirikizumab in the treatment of inflammatory bowel disease. From bench to bedside. J Clin Med 2025; 14(3): 1001. doi: 10.3390/jcm14031001.